摘 要:CT影像具有空间分辨率高的优点,是肺部疾病影像学诊断的首选方式。肺部病灶的检测和测量、肺功能的定量分析均需要精确的肺组织分割。为解决CT影像由于噪声、伪影、部分容积效应等干扰而导致的肺部各组织之间灰度交叠、边界模糊、难以分离的问题,系统地综述了针对肺部各个分割对象的有效解决方法。从肺实质分割、肺血管分割、肺气道分割、肺叶分割、肺结节分割以及肺部病变组织的分割等方面,详细分析了面临的挑战性问题和当前研究进展,并阐述了肺组织分割方法的发展趋势。
关键词:肺组织分割;肺实质分割;肺血管分割;肺气道分割;肺叶分割;肺结节分割;肺部病灶分割。
引言
CT影像空间分辨率较高、各方向接近各向同性。CT检查对胸部疾病的诊断、鉴别具有重要价值。近年来,利用计算机技术对CT影像进行处理分析、获取对医生有参考价值的病
灶/异常等辅助信息的计算机辅助检测/诊断(CAD)[1,2]成为研究的热点。面向肺部疾病的CAD[3,4]可以通过CT影像检测小病灶、定量分析病灶、评估肺功能的改变程度,如肺气肿的定量分析[5,6]、弥漫性肺病的定量评估[5,7]、肺结节的辅助诊断[8,10]、肺栓塞检测[9,10]等。肺组织分割是指对肺部解剖结构
中的正常组织的分割和对肺部异常生长或改变的病变组织的分割。肺部正常组织分割是疾病检测和识别的基础,如在肺实质区域内检测肺结节;肺血管内部识别肺栓塞。肺部病变组织
的分割是疾病定量分析和辅助诊断的基础,如肺结节的随访检查是比对同一病人不同时间扫描的肺结节,通过结节长轴、体积等信息判断结节增长情况,为自动测量这些信息需要分割肺
结节。
积等信息判断结节增长情况,为自动测量这些信息需要分割肺结节。近年来,随着医学图像处理与分析研究的深入以及在临床上的广泛应用,已经有很多医学影像分割方面的研究文献。林瑶等人[11]将医学图像分割分为基于区域的方法(阈值、分水岭、区域增长、分类聚类、随机场等)、基于边缘的方法(并行微分算子、LiveWire、形变模型等)、二者混合的方法(图切割、统计形状模型等)、基于模糊理论的方法、基于神经网络的方法等。江贵平等人[12]将医学图像分割分为基于信息和基于模型两大类方法,其中基于信息的方法包括基于体素(如阈值、直方图)和基于区域(如区域增长、分水岭)的两类方法;基于模型的方法包括基于局部先验(如图切割、马尔可夫随机场)和全局先验(如活动轮廓模型、图谱)的分割方法;此外还有基于配准的分割方法以及基于人工智能的分割方法。还有一些研究者系统介绍了某一类方法,如刘松涛等人[13]对图切割方法作了系统的综述,段丁娜等人[14]对基于活动轮廓模型的图像分割方法作了全面的综述。
每个成像系统有自身的特长和局限,因此不存在可以解决各类医学图像分割问题的通用方法,通常是针对某种模态(如X线、超声、CT、MR、PET、SPECT)图像的特点有针对性地进行分割。医学图像的分割需要引入临床中大量的解剖知识,如肺气道与肺动脉是伴行的,肺裂缝附近没有大的血管等;而这些先验知识只适用于具体的分割对象。因此医学影像的分割方法的研究是面向具体应用的,每种应用有其自身的难点和挑战性问题。本文基于CT影像,以肺部的各种解剖组织和病变组织为主线,梳理各种肺组织分割应用面临的挑战性问题,评述解决各种问题的研究思路与方法。
1 肺组织的CT 影像
肺位于胸腔,左右肺各居纵隔两侧,其中右肺有上、中、下三个肺叶,左肺有上、下两个肺叶,各肺叶由肺裂缝分隔。肺气道由环状软骨开始,经颈部和上纵隔在正中面下行,在胸腔分成两个主支气管。肺气道进入肺内部后逐级分支形成树状结构,由气管至肺泡可分23~25级,在肺泡完成血氧交换。肺部血液循环通过动脉血管树和静脉血管树完成。动脉血管树为肺注入血液,通常与气管伴行;静脉血管树从肺中带走血液,通常不与气管伴行。肺由肺实质与肺间质组成:肺实质为肺部具有气体交换功能的含气间隙及结构,包括肺泡与肺泡壁;肺间质包括结缔组织及血管、淋巴管、神经等。CT成像质量的好坏直接关系到疾病的临床诊断,也决定了图像处理的难度。CT的空间分辨率[15]较高,可以分辨0.2~0.3mm影像细微结构,
相当于第7~9级细支气管的特征性的肺部解剖细节。肺组织之间的自然对比度好,肺部CT成像的重建内核采用骨重建算法[16],使所观察的组织结构边缘锐利清晰并能保持细节。对于肺部CT,即使很低的剂量仍能获取高质量和低噪声。
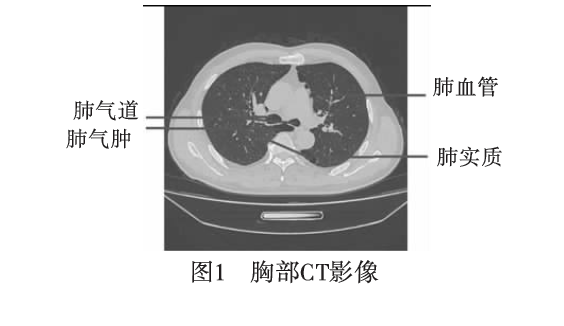
图1显示了胸部CT的某一层横断面,可以清晰地观察人体内组织器官结构。每层胸腔CT图像中有胸廓外组织(皮肤、肌肉和脂肪等)、胸廓(肋骨、脊柱等)、肺及肺内血管气管组织和内部脏器(心脏等)。肺实质普遍呈现低衰减,与胸廓外组织和胸廓对比度较高。但由于炎症和纤维化病症的影响,肺实质可呈现高密度的病灶。而肺气肿等肺实质的损坏造成空气的潴留,肺实质内呈现低密度的空洞病灶。肺气道内腔充满空气,与肺实质的密度接近,它们之间由高亮度的肺气道壁相间隔。当没有为病人注入造影剂时,肺动脉和肺静脉在CT上都为高亮,但无法从亮度模型进行区分。正常人的CT上看不到肺间质,增厚时常能见到。
2 肺组织分割方法
肺组织分割指的是对肺内正常组织(如肺实质、肺气道、肺血管、肺叶等)或肺内病态组织(如肺结节、间质性肺疾病的病变组织)的分割。由于CT影像的形成受到诸如噪声、部分容积效应、偏移场效应和运动等的影响,CT影像与普通图像相比具有模糊、不均匀性,可能存在条形、环状、运动等伪影的特点。另外,人体的解剖组织结构和形状复杂,个体之间差别较大,这些都给医学图像的分割带来了困难。单一的分割技术或者完全失败,或者需要一些特殊的处理技术,因此有必要针对肺组织分割应用这个领域,对图像分割方法进行研究。
2.1 肺实质分割
正常人的肺区域(包括肺实质和肺气道)周围充满空气、密度较小,与周围肋骨组织的差别明显,在CT图像上反映为CT值的不同,因此肺部区域的提取相对容易。但肺实质与肺
气道难以准确分离,它们之间分割的准确性也是密不可分、相辅相成的。很多肺气肿患者的肺是膨胀的,往往在前后联合的位置左右肺挤到了一起,反映在CT影像上左右肺内侧狭窄的
纵膈与肺实质对比度接近、边界模糊,在肺组织分割的过程中可能发生左右肺粘连的现象。
2.1.1 肺实质整体分割
在CT影像上,正常人的肺实质与周围软组织具有较高的对比度,因而很多研究人员采用基于阈值的方法提取肺实质。肺实质由于严重炎症、癌症等导致大面积的、形状各异的高密
度区极难分割,为此,研究人员需要一些定位信息的支持,如肺实质的边界应位于肋骨附近。虽然病变患者的肺实质密度发生了变化,但肋骨的密度和形态比较固定,因而可以比照肋骨
这样一个参照物进行病变图像的分割。
阈值是在分割时作为区分物体与目标像素的门限。阈值法的关键问题是确定一个最优阈值,如果无法从整幅图像的信息求出最优分割阈值,人们试图为图像中不同区域求取相应的
阈值,再利用这些阈值对各个区域进行分割,这种方法也称为自适应阈值。阈值方法由于计算简单、运算效率高、速度快,在任何实际应用的图像处理系统中几乎都有运用。阈值法的缺
点是对于目标与背景之间灰度差异不大时,或者目标与背景有较大的灰度区间重叠时,难以得到准确的分割结果。Hu等人[17]开创了一个经典的肺分割流程,即灰度阈值分割、连接度分析、左右肺分离,形态学闭合肺内高密度结构。采用了一种迭代阈值优化方法,然后寻找最大两个连通分量,肺粘连时通过不断形态学腐蚀的方法将其分离。这类方法称之为经典的肺分割方法,很多研究人员在此框架下继续研究,提出不同部分的改进方法,如郭圣文等人[18]使用全局自适应阈值分割与轮廓跟踪方法提取肺部实质区域,并应用基于密度分布的肺气肿量化诊断标准确定病变区域与程度。贾同等人[19]综合利用了阈值分割、区域增长及数学形态学等算法,并在特定体层通过图搜索算法精确定位左右肺前后连接线狭窄区域。袁克红等人[20]用阈值法和边界跟踪算法得到初始的肺部轮廓,然后基于计算局部二维凸包的方法对原始的肺部轮廓进行修正。
图像配准是在两幅图像的对应点之间建立一对一映射的过程,即将两幅图像中空间同一位置的点联系起来。通过使用配准的方法都是试图引入一些外部信息来辅助分割。参考图像中包含外部信息,配准后,参考图像中被分割的结构可以映射至需要分割的图像。配准可以分为基于灰度的配准、基于特征的配准、刚性配准和非刚性配准。肺部运动为非线性的,因此一般采用非刚性配准。Sluimer等人[21]提出一种基于弹性配准的分割方法,该方法考虑借助肺外部的肋骨定位,而不依赖于的肺实质的密度,该方法对严重的肺纤维化和大的肿瘤影像表现更为鲁棒。Prasad等人[22]针对弥漫性肺病开发了一个算法,为了克服疾病区域的误分,自动检测肋骨的曲率,借助肋骨边界的曲率相似于肋骨的曲率这一关系自适应阈值;该方法的缺点是在纵膈区域容易造成过分割。
主动形状模型利用全局的先验信息,将目标看做是参考形状中的一种。主动形状模型基于几何和模板形状的知识表达,由于解剖结构存在显著差异,需建立多个具有代表性的模板形状,也称为统计形状建模。Sun等人[23]使用鲁棒的主动形状模型(RASM)分割肺轮廓,RASM的初始位置由肋骨分割结果引导,然后使用优化表面进一步平滑肺轮廓。
这些方法借助肋骨定位信息,利用弹性配准、主动形状模型等方法,试图摆脱对肺实质的密度的依赖。图2[23]为对于肺内具有高密度病变的图像阈值方法和主动形状模型方法的对比,其中(a)为原始图像,(b)为传统的阈值方法的分割结果,(c)为借助肋骨定位的主动形状模型方法的分割结果。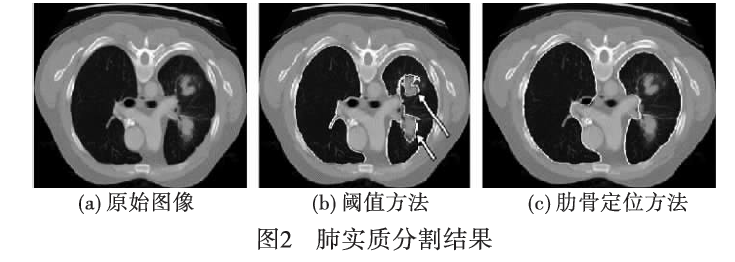
2.1.2左右肺分离
肺气肿等患者常常在纵隔区域发生左右肺粘连,左右肺之间的边界微弱。将左右肺分离开来有两种思路:a)利用边缘信息,采用动态规划的方法搜索弱边界;b)利用形态信息将很
细的部位腐蚀开。两个具有不同灰度值的相邻区域之间总存在边缘。边缘是灰度值不连续的结果,CT图像中这种灰度值的不连续反映的通常是不同组织密度的变化。图像灰度的变化情况可以用图像灰度分布的梯度来反映,因此可以利用一阶导数和二阶导数检测图像边缘。一阶微分算子通过一阶导数幅度峰值来检测边缘位置,主要包括Roberts算子、Prewitt算子和Sobel算子等。二阶微分算子通过二阶导数过零点检测边缘位置,主要包括LOG算子、零交叉算子、Canny算子等。二阶算子比一阶算子对细小边缘的敏感性较高,但是受噪声影响伪边缘也较多。边缘检测方法的缺点恰恰在于检测精度和抗噪性的矛盾。动态规划(dynamicprogramming)是一种解决多阶段决策过程的最优化方法,它通过定义一个体现“最优边界”的代价函数,将边界追踪方法表示为动态规划的公式。基于动态规划的分割方法实际上是将边缘点的检测融入代价函数的计算从而把边缘检测和边界连接结合起来。通过使用动态规划可以得到稳定、唯一的全局最优解,而且不需要大量的初始化点。Armato等人[24]采用动态规划的方法分离左右肺;Park等人[25]在纵膈附近两肺可能粘连的边界上查找粘连位置,支持前后联合多处粘连的处理,然后在ROI内采用动态规划的方法分离左右肺。
数学形态学的数学基础是集合论,基本思想是用具有一定形态的结构元素去量度和提取图像中的对应形状以达到对图像分析和识别的目的。数学形态学由一组形态学的代数运算子组成,基本运算有四个:膨胀、腐蚀、开、闭。分水岭分割方法是一种基于拓扑理论的数学形态学的分割方法,其基本思想是把图像看做是测地学上的拓扑地貌,图像中每一点像素的灰度值表示该点的海拔高度,每一个局部极小值及其影响区域称为集水盆,而集水盆的边界则形成分水岭。分水岭算法对微弱边缘具有良好的响应,图像中的噪声、物体表面细微的灰度变化都会产生过度分割的现象。但同时应当看出,分水岭算法对微弱边缘具有良好的响应,是得到封闭连续边缘的保证。HU等人[17]采用腐蚀的方法分离粘连的左右肺;Kuhnigk等人[26]应用分水岭算法分离左右肺。
2.2肺气道分割
由于部分容积效应、噪声和管腔粘液的影响,在CT影像上肺气道内密度分布不均匀,末端易出现局部管壁断裂现象。随着肺气道逐步延伸至肺实质中,气道壁逐渐变薄,气道内部
和相邻的肺实质在CT值上十分接近,任何气道壁小的缺失将导致肺气道分割过程中泄漏(leakage)至肺实质。细支气管的提取问题决定着肺气道分割算法的成败,因为多数算法对于3级以上较粗的气管分支都能够很好地提取,差别就在于细支气管的提取。泄漏主要发生在细支气管处,细支气道容易被当做泄漏剪掉,泄漏也容易被当做新的细支气管保留。
2.2.1 肺气道内腔的分割
肺气道具有树状连通的结构,但由于内腔的灰度分布不均匀,气道跟踪的过程中气道壁和内腔像素的灰度有可能重叠。肺气道分割方法基本都利用了连通的性质,主要有区域增长、
图优化等方法。区域增长方法是一种从单个像素出发,逐渐合并以形成所需分割区域的串行分割技术。区域增长方面的需要解决的三个重要问题是:选择或确定一种能正确代表所需区
域的种子像素;确定在生长过程中能将相邻包括进来的准则;制定让生长过程停止的条件或规则。区域增长方法的优点是计算简单、可以引入先验知识,缺点是迭代耗费时间长,可能造
成空洞或过分割现象。Tschirren等人[27]采用多种子点模糊连接的方法分割肺气道,由于需要构造亲和力函数来计算相似度,增加了算法的复杂度,比较耗时。姜慧研等人[28]提出改进的区域生长法,采用动态局部阈值和节点理论来分割气管树,但是种子点需要人工指定。齐守良等人[29]提出一种人体气道树的快速自动提取算法,其中包括三维区域生长、三维波传递和形态学优化三个步骤,通过多次迭代完成最终提取。区域生长的作用是提取气道树主体,三维波传递和形态学优化用于提取外围细支气管。在波传递中采用模糊逻辑判据,并利用形态学特征防止泄漏。这些采用区域生长或波面传播法(wavefrontpropagation)的方法速度较快,但精度不高。
Fetita等人[30]首先采用三维形态学算子提取远端气管,再基于能量最小化原理实现三维重建。Lo等人[31]利用一组易于获取的、不完整的气道分割结果训练外观模型,并且引入了管道方向相似性特征,用以测量疑似气道和周围管道方向的相似程度。Graham等人[32]利用局部和全局信息,首先通过保守区域生长获得气管主体,再找出所有疑似气管的位置,最后采用基于图的最优化方法衡量保留疑似气管的好处和代价。Pu等人[33]利用气道的管状表面模型计算主曲率和主方向,提取出气管区域,该方法的主要问题是无法提取外围细小气道。
2.2.2 肺气外壁的分割
气道壁的分割方法大体可以分为二维和三维方法。二维气道壁分割方法可以直接应用于横断面,但最好是应用于垂直于气道中心线的MPR面。半高全宽(FWHM)方法[34]是一种常用的二维气道壁厚的测量方法,假定气道壁的内边界位于管腔和最大CT值像素中间的位置,气道壁的外边界位于最大CT值像素和肺实质中间的位置。FWHM方法高度依赖重建核和气道大小。随机游走(randomwalk)算法是一种交互式图像分割方法,它根据图的权值和度定义了一个转移概率,使得网络的权值反映随机行走者沿这条边行走的概率。随机游走算法可以处理含有强噪声、弱边界或缺失边界、有模棱两可的区域的图像;但分割的质量依赖于种子点的选择、速度较慢。随机游走算法通常用于一些小目标的分割。Xu等人[35]采用传统的肺气管壁分割方法半宽半高法获取气管内外壁的种子点,然后使用这种改进的随机
游走方法得到更为精确的肺气管壁,如图3[35]所示。
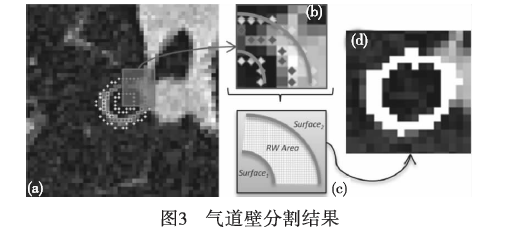
虽然MPR重采样垂直于气道方向,但二维方法在气道分叉点附近往往不能产生正确的结果。为了克服二维气道壁分割的缺点,提出了几种三维气道壁分割方法。Liu等人[36]从现有的气道管腔分割的网格结果出发,使用一个优化的图搜索算法同时分割管腔和气道壁边界。Petersen等人[37]提出了一种新的基于非交叉流动线的多表面分割方法。Gu等人[38]提出了一个三维活动表面演化,最小化能量函数使得外部和内部能量平衡。
2.3 肺血管分割
肺血管呈现错综复杂的树型结构,肺内包含23级分支,管径在20μm~15mm范围内变化。在CT影像上,肺血管因内部充盈血液总体上显示高密度影,但灰度分布并不均匀,尤其细小血管受部分容积效应的影响较大。肺血管周围充满粘液的气管、肺结节和一些高密病变都会干扰肺血管提取的准确性。肺血管不论粗细都呈现一种中空的管状结构,因而可以通过识别这种形态特征来分割肺血管。
血管表现模型(appearancemodels)是指血管的亮度统计属性。传统的阈值、区域增长、波传递、模糊连接度等方法更多地利用了血管表现模型,从种子点生长出血管树。Lassen等人[39]为了引导肺叶的分割,采用阈值方法大致分割了肺血管。Bue
low等人[40]提出一种树状结构提取算法,从一组种子点开始采用快速步进方法进行演化,根据阈值决定是否包括当前像素。演化的过程中定期检查演化的前端(front),如果前端分裂,表示检测树有分叉。在生长过程中对当前分支进行评估,如果半径超过一定的最大值认为是泄漏。此类方法对噪声十分敏感,在血管灰度不连续处往往失败,细小血管常常遗漏较多。
水平集方法[41]由于易于处理拓扑的变化和复杂的目标、易于描述轮廓的几何性质、易于向高维推广等优点,得到了广泛的研究和应用。为了利用图像的区域特征,Chan和Vese[42]提出了一种基于MumfordShah的ChanVese(CV)模型,在处理弱边缘时取得了很好的效果。CV模型综合利用了整个图像区域的全部信息,具有全局优化特性。初始轮廓曲线无须完全定位于目标内部或外部,仅需要一条初始轮廓曲线,就可以分割即使内部含有空洞的目标。另外,该模型不依赖于目标边缘特征,故而即使目标边缘比较模糊,该方法仍然能够得到比较理想的结果[43]。贾同等人[44]提出一种基于CV模型的肺血管分割算法,首先定位血管内外同质区域;然后通过目标边缘能量的计算使曲面沿着图像梯度方向的二阶导数进行演化,以使其精确收敛到目标边缘。
血管几何模型(geometrymodels)是指血管具有细长、管状、树状分布的形状特点的先验知识。Hessian矩阵特征分析方法可有效地识别球形对象、圆柱形对象、片状对象,因而被应用于血管的分割和肺结节的检测[45]。Frangi等人[46]提出的血管滤波器就是利用血管几何模型进行多尺度的血管检测;然而,该血管滤波器在分叉连接处响应较弱,经阈值化分割后容易造成血管不连续。尚岩峰等人[47]提出一种管状特性和主动轮廓的血管提取方法,但对于肺血管分割需要在主气管上找20个点作为初始轮廓。Korfiatis等人[48]提出一种在有IDL疾病的影像中提取肺血管的方法,首先通过基于Hessian的多尺度滤波进行血管增强,然后通过纹理分析的方法消除炎症等高密度干扰造成的过分割。
2.4肺叶分割
肺由肺裂缝分成五个肺叶,每个肺叶均为功能相对独立的单位。在正常的、不存在疾病异常的肺中,肺裂缝可以作为不同肺叶之间明显的界限;但不同的个体之间,肺裂缝的形态和
结构是很不相同的。在CT上,肺裂缝还经常是不完整的。从解剖结构上,不同肺叶对应不同的支气管的子树和血管树的子树,因而可以借助这些信息来定位不同肺叶之间的边界。
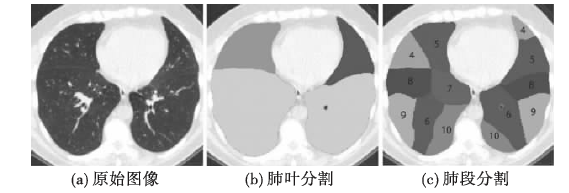
以解剖学知识为基础的自动检测方案,需要依赖局部或全局的肺结构解剖学知识。因为肺裂附近通常没有较大的血管,所以Kuhnigk等人[49]基于血管分割使用距离变换实现肺裂检测,利用一个交互式的三维分水岭算法识别肺叶。Lassen等人[39]在Kuhnigk的基础上,将肺裂缝分割的信息和肺气道分割的信息引入代价函数,进行三维分水岭分割。Ukil等人[50]使用气管和血管提供的解剖信息找到肺叶大致的范围(ROI),在ROI内利用脊增强和图搜索技术精确追踪肺裂缝。VanRikxoort等人[51]利用肺血管和肺气道分割结果,使用线性判别分类器分割肺叶和肺段,如图4[51]所示。
图谱引导(atlasguided)方法是利用标准模板对医学图像进行分割,将图像分割转换为图像配准的问题,将标准图谱通过线性或非线性映射到待分割的图像上。图谱引导的分割方法的精度取决于图谱图像构造方法和图谱与输入图像的配准方法。Zhang等人[52]提出一种模板引导的肺叶分割方法,首先从16个个体数据中构造肺的图谱,然后使用一种脊测量方法增强肺裂缝,最后在模糊系统中综合影像灰度、解剖平滑约束和基于图谱的肺裂缝初始化三个来源的信息进行分析,得到最终的肺叶分割结果。VanRikxoort[53]由肺裂缝、肺边界,支气管树等信息构造代价函数,肺气管等信息仅在缺少肺裂缝信息时使用。为了配合解剖肺叶形状的变化,使用5例具有完整肺缝的数据构造一个图谱;采用多模板选择机制,完整的肺裂缝分割通过最优的图谱弹性配准获取。
2.5肺结节分割
肺结节分割常用于肺结节体积的估算。相比肺结节直径的估计,肺结节的体积是评价结节大小变化更合适的参数。
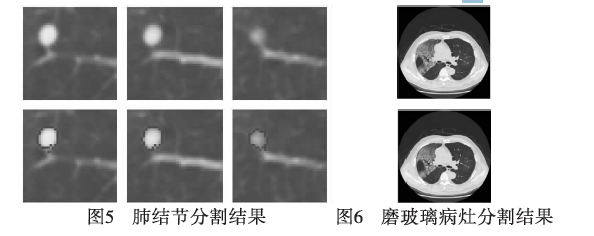
肺结节从位置和形态上可以分为四种类型[54,55]:类圆形的、血管粘连的、彗星尾的、胸壁粘连的。肺结节分割的最难点在于有可能连接血管或胸膜。肺结节的分割方法可以分为基于灰度的方法、基于图切割的方法等。阈值方法仅能分割边界清晰的实性(solid)结节,而对于粘连有相似灰度结构的结节则需要更复杂的处理。肺结节分割结果如图5[51]所示。
Kostis等人[56]采用阈值方法分离结节,并采用数学形态学的开操作分离结节和粘连的血管,再通过一个迭代的扩张过程重建结节的边界。Kuhnigk等人[57]的方法也是基于阈值,但可以同时处理小结节和大结节,在大结节和血管之间通常有明显的融合。Okada等人[58]的策略是使用一个具有高斯分布的椭球模板来匹配肺结节。Diciotti等人[54]提出一种交互式的分割方法,通过多阈值测量影响区域,基于灰度相似性和形状分离结节。
2.6间质性肺病的病灶分割
间质性肺疾病(interstitiallungdisease,ILD),也称为弥漫性实质性肺疾病(diffuseparenchymallungdisease,DPLD),包含超过150种的肺薄壁组织。由于间质性肺疾病呈现磨玻璃状病灶、蜂窝状病灶等多种形态,多采用统计或者训练的方法。
深度学习[66,67]的概念起源于人工神经网络[60,68]的研究,含多隐层的多层感知器就是一种深度学习结构。深度学习的本质是通过构建多隐层的模型和海量训练数据来学习更有用的特征,从而最终提升分类或预测的准确性。深度学习直接作用于原始数据,通过学习一种深层非线性网络结构实现复杂函数逼近,表征输入数据分布式表示。卷积神经网络(convolutionalneuralnetwork,CNN)[66]是从生物学中猫的视觉皮层模型演化而来的一种神经网络模型。在CNN中,图像的一小部分(局部感受区域)作为层级结构的最低层的输入,信息再依次传输到不同的层,每层通过一个数字滤波器去获得观测数据的最显著的特征。由于设计中应用了稀疏连接、权值共享、最
大池化等概念,卷积神经网络较一般神经网络在图像处理方面有如下优点:a)输入图像和网络的拓扑结构能很好地吻合;b)特征提取和模式分类同时进行,并同时在训练中产生;c)权重共享可以减少网络的训练参数,使神经网络结构变得更简单,适应性更强。CNN中这种层间联系和空域信息的紧密关系使其适于图像处理和理解,且在自动提取图像的显著特征方面还表现出了较优的性能。Li等人[70]提出一种自适应的卷积神经网络区分不同类别的ILD。马尔可夫随机场(Markovrandomfield,MRF)模型提供了。方便有效的方法来描述图像的像素具有的一些空间相关特性。MRF与吉布斯(Gibbs)分布等价,使用贝叶斯最大后验概率(maximumaposterior,MAP)对其进行估计,形成MAPMRF框架。基于MRF模型的分割方法将像素的标号问题转换成求解能量函数的最小值问题,从而实现图像分割。该方法对噪声具有鲁棒性,但难以选择合适的参数控制空间相关的强度,过强将导致分割边缘过于平滑而失去重要的解剖细节信息。间质性肺疾病早期呈现磨玻璃状病变,影像学表现为肺密度轻度增加呈雾状,内可见血管纹理,类似于磨玻璃样,边界不清。李梭[71]采用常于描述领域像素间相关关系的马尔可夫随机场模型对磨玻璃病灶区域进行二维分割,分割结果如图6所示。
3、' 结束语
肺部组织分割具有分割对象复杂、针对性强的特点,在应用过程需要根据自身特点引用和借助一些先验知识、设计专门的处理流程并融合多种方法。肺组织分割方法的深入研究对肺部疾病的诊断、病理机制的研究、手术规划的制定、病人的随访都具有广阔的临床应用价值和前景。
由于人体解剖结构本身的复杂性和CT成像的特点,目前没有一种对所有部位医学影像都适用的全自动分割方法以满足临床需求。CT影像的分割涉及噪声、灰度不均匀、边界不清
晰等问题,本文针对肺部组织分割面临的各种问题和现有的一些解决方法作了比较详细的探讨。虽然已有很多针对具体肺组织分割应用的方法,但仍有很多问题亟待解决。
通过对现有方法的分析,可以预见未来肺组织分割的研究热点和发展趋势包含以下几点:
a)基于先验信息的分割方法的研究。对于复杂形状和结构的分割往往需要利用先验知识,如活动轮廓模型、图切割等均可引入形状先验知识,在灰度、边缘等图像特征的驱动下实现能量优化。由于CT成像的原因造成部分组织边界的不清晰,如肺气道的泄露现象、肺裂缝的缺失,人们已经很难用简单的规则进行分割,所以需要借助先验信息进行分割。a)基于先验信息的分割方法的研究。对于复杂形状和结构的分割往往需要利用先验知识,如活动轮廓模型、图切割等均可引入形状先验知识,在灰度、边缘等图像特征的驱动下实现能量优化。由于CT成像的原因造成部分组织边界的不清晰,如肺气道的泄露现象、肺裂缝的缺失,人们已经很难用简单的规则进行分割,所以需要借助先验信息进行分割。
c)基于机器学习的分割方法的研究。深度学习等具有智能学习的方法已成功应用于对不同图像的检索和分类,展示出强大的识别能力。对于弥漫性肺病,病灶形态各异,能否利用
一些具有智能学习的特性分割方法对目标进行自动分类,也成为研究的热点。
b)基于配准的分割方法的研究。在肺结节放疗计划和随访中,采用配准方法跟踪由于呼吸运动和解剖结构变化导致的移动肺结节。对于一些特定的解剖区域,考虑分割对象的形状
信息、不同结构间的关系,采用图谱引导分割也是一种有效的方法。图谱引导方法的质量取决于图谱的构建和采用的配准方法。因此,随着时序图像分割需求的增加和多模板技术的流行,采用配准方法解决分割问题成为不可或缺的手段。
[1] DoiK.Currentstatusandfuturepotentialofcomputeraideddiagnosisinmedicalimaging[J].BritishJournalofRadiology,2005,78(1):319.
[2] DoiK.Computeraideddiagnosisinmedicalimaging:historicalreview,currentstatusandfuturepotential[J].ComputMedImaging Graph,2007,31(45):198211.
[3] VanGinnekenB,TerHaarRomenyBM,ViergeverMA.Computeraideddiagnosisinchestradiograpy:asurvey[J].IEEETransonMedicalImaging,2001,20(12):12281241.
[4] SluimerI,SchilhamA,ProkopM,etal.Computeranalysisofcomputedtomographyscansofthelung:asurvey[J].IEEETransonMedicalImaging,2006,25(4):385405.
[5] HoffmanEA,SimonBA,McLennanG.Astructuralandfunctionalassessmentofthelungviamultidetectorrowcomputedtomography:phenotypingchronicobstructivepulmonarydisease[J].ProceedingsoftheAmericanThoracicSociety,2006,3(6):519532.
[6] CTlungdensityanalysis[EB/OL].http://www.vitalimages.com/solutions/clinicalinsight/vitreasoftware/vitreademonstrations.
[7] CTCOPD[EB/OL]. http://www.usa.philips.com/healthcareproduct/HCAPP010/ctcopd
[8] LiQiang.RecentprogressincomputeraideddiagnosisoflungnodulesonthinsectionCT[J].ComputerizedMedicalImaging&Graphics,2007,31(45):248257.
[9] ChanHP,HadjiiskiL,ZhouC,etal.Computeraideddiagnosisoflungcancerandpulmonaryembolismincomputedtomography:areview[J].AcademicRadiology,2008,15(5):535555.
[10] ThoracicVCAR [EB/OL].http://www3.gehealthcare.com/en/
products/categories/advanced_visualization/applications/thoracic_
vcar.
[11]林瑶,田捷.医学图像分割方法综述[J].模式识别与人工智能,
2002,15(2):192204.
[12]江贵平,秦文健,周寿军,等.医学图像分割及发展现状[J].计算
机学报,2015,38(6):12221242.
[13]刘松涛,殷福亮.基于图割的图像分割方法及其新进展[J].自动
化学报,2012,38(6):911922.
[14]段丁娜,张欢,邱陈辉,等.基于活动轮廓模型的图像分割算法综
述[J].中国生物医学工程学报,2014,34(4):445454.
[15]李松柏,徐克.多层螺旋CT临床诊断实践图谱[M].北京:人民
军医出版社,2004:1318.
[16]蔡祖龙,高元桂.胸部CT与MRI诊断学[M].北京:人民军医出版社,2005:35.
[17]HuShiying,HoffmanEA,ReinhardtJM.AutomaticlungsegmentationforaccuratequantitationofvolumetricXrayCTimages[J].IEEETransonMedicalImaging,2001,20(6):490498 [18]郭圣文,陈坚,曾庆思.胸部CT中肺实质的自动分割与计算机辅助诊断[J].华南理工大学学报:自然科学版,2008,36(1):7275.
[19]贾同,孟?,赵大哲,等.基于CT图像的自动肺实质分割方法[J].东北大学学报:自然科学版,2008,29(7):965967.
[20]袁克虹,向兰茜.用于计算机辅助诊断的肺实质自动分割方法[J].清华大学学报:自然科学版,2011,51(1):9095.
[21]SluimerIC,ProkopM,VanGinnekenB.TowardautomatedsegmentationofthepathologicallunginCT[J].IEEETransonMedicalImaging,2005,12(8):10251038.
[22]PrasadMN,BrownMS,AhmadS,etal.Automaticsegmentationoflungparenchymainthepresenceofdiseasesbasedoncurvatureofribs[J].AcademicRadiology,2008,15(9):11731180.
[23]SunShanhui,BauerC,BeichelR.Automated3Dsegmentationof
lungswithlungcancerinCTdatausinganovelrobustactiveshapemodelapproach[J].IEEE TransonMedicalImaging,2012,31(2):449460. [24]ArmatoSG,SensakovicW F.AutomatedlungsegmentationforthoracicCTthoracicCT:impactoncomputeraideddiagnosis[J].AcademicRadiology,2004,11(9):10111021.[25]ParkSC,LeaderJK,TanJ,etal.Separationofleftandrightlungs
using3dimensionalinformationofsequentialcomputedtomographyimagesandaguideddynamicprogrammingalgorithm[J].JournalofComputerAssistedTomography,2011,35(2):280289.[26]KuhnigkJM,DickenV,ZidowitzS,etal.NewtoolsforcomputerassistanceinthoracicCT,partI:functionalanalysisoflungs,lunglobes,andbronchopulmonarysegments[J].Radiographics,2005,25(2):525536.
[27]TschirrenJ,HoffmanEA,McLennanG,etal.Intrathoracicairwaytrees:segmentationandairwaymorphologyanalysisfromlowdoseCTscans[J].IEEETransonMedicalImaging,2005,24(12):15291539[28]姜慧研,张晔.基于改进的区域生长法的气管与支气管分割[J].东北大学学报:自然科学版,2009,30(2):191194.
[29]齐守良,岳勇,朱辰坤,等.一种人体气道树快速自动提取算法的
设计[J].东北大学学报:自然科学版,2013,34(2):186190.
[30]FetitaCI,PreteuxF,AubryCB,etal.Pulmonaryairways:3DreconstructionfrommultisliceCTandclinicalinvestigation[J].IEEETransonMedicalImaging,2004,23(11):13531364.
[31]LoP,SporringJ,AshrafH,etal.Vesselguidedairwaytreesegmentation:avoxelclassificationapproach[J].MedicalImageAnalysis,2010,14(4):527538.
[32]GrahamMW,GibbsJD,CornishDC,etal.Robust3Dairwaytreesegmentationforimageguidedperipheralbronchoscopy[J].IEEETransonMedicalImaging,2010,29(4):982997.
[33]PuJ,FuhrmanC,GoodW F,etal.Adifferentialgeometricapproachtoautomatedsegmentationofhumanairwaytree[J].IEEETransonMedicalImaging,2011,30(2):266278.
[34]ReinhardtJM,D’SouzaND,HoffmanEA.Accuratemeasurementofintrathoracicairways[J].IEEE TransonMedicalImaging,1997,16(6):820827
[35]XuZhiyue,BagciU,FosterB,etal.Spatiallyconstrainedrandomwalkapproachforaccurateestimationofairwaywallsurfaces[C]//Procofthe16thInternationalConferenceonMedicalImageComputing&ComputerAssistedIntervention.Berlin:Springer,2013:559566.
[36]LiuXin,PrimakAN,YuLifeng,etal.QuantitativeevaluationofnoisereductionalgorithmsforverylowdoserenalCTperfusionimaging[C]//ProcofSPIE,MedicalImaging:InternationalSocietyforOpticsandPhotonics.2009.
[37]PetersenJ,NielsenM,LoP,etal.Optimalgraphbasedsegmenta
tionusingflow lineswithapplicationtoairwaywallsegmentation[C]//Procofthe22ndInternationalConferenceonInformationProcessinginMedicalImaging.Berlin:Springer,2011:4960.
[38]GuSuicheng,FuhrmanC,MengXin,etal.ComputerizedidentificationofairwaywallinCTexaminationsusinga3Dactivesurfaceevolutionapproach[J].MedicalImageAnalysis,2013,7(3):283296.
[39]LassenB,VanRikxoortEM,SchmidtM,etal.AutomaticsegmentationofthepulmonarylobesfromchestCTscansbasedonfissures,vessels,andbronchi[J].IEEETransonMedicalImaging,2013,32(2):210222.
[40]BuelowT,WiemkerR,BlaffertT,etal.AutomaticextractionofthepulmonaryarterytreefrommultisliceCTdata[C]//ProcofSPIE,MedicalImaging,Physiology,Function,andStructurefrom MedicalImages.2005:730740
[41]OsherS,SethianJA.Frontspropagatingwithcurvaturedependentspeed:algorithmsbasedonHamiltonJacobiformulations[J].JournalofComputationalPhysics,1988,79(1):1249.
[42]ChanTF,VeseLA.Activecontourmodelwithoutedges[J].IEEETransonImageProcessing,2001,10(2):266277.[43]郝家胜.基于几何流的医学图像分割方法及其应用研究[D].哈
尔滨:哈尔滨工业大学,2008.
[44]贾同,魏颖,吴成东.基于几何形变模型的三维肺血管图像分割方
法[J].仪器仪表学报,2010,31:22962301.
[45]AgamG,ArmatoSGI,WuC.Vesseltreereconstructioninthoracic
CTscanswithapplicationtonoduledetection[J].IEEETranson
MedicalImaging,2005,24(4):486499.
[46]FrangiAF,NiessenW J,VinckenKL,etal.Multiscalevesselen
hancementfiltering[C]//MedicalImageComputingandComputer
AssistedInterventation.Berlin:Springer,1998:130137.
[47]尚岩峰,汪辉,汪宁,等.管状特性和主动轮廓的3维血管自动提
取[J].中国图象图形学报,2013,18(3):290298.
[48]KorfiatisPD,KalogeropoulouC,KarahaliouAN,etal.Vesseltree
segmentationinpresenceofinterstitiallungdiseaseinMDCT[J].
IEEETransonInformationTechnologyinBiomedicine,2011,15
(2):214220.
[49]KuhnigkJM,HahnH,HindennachM,etal.Lunglobesegmenta
tionbyanatomyguided3Dwatershedtransform[C]//ProcofSPIE,
MedicalImaging:InternationalSocietyforOpticsand Photonics.
2003:14821490.
[50]UkilS,ReinhardtJM.AnatomyguidedlunglobesegmentationinX
rayCTimages[J].IEEETransonMedicalImaging,2009,28(2):
202214.
[51]VanRikxoortEM,DeHoopB,VandeVorstS,etal.AutomaticsegmentationofpulmonarysegmentsfromvolumetricchestCTscans[J].IEEETransonMedicalImaging,2009,28(4):621630.
[52]ZhangLi,HoffmanEA,ReinhardtJM.AtlasdrivenlunglobesegmentationinvolumetricXrayCTimages[J].IEEETransonMedicalImaging,2006,25(1):116[53]VanRikxoortEM,ProkopM,DeHoopB,etal.Automaticsegmentationofpulmonarylobesrobustagainstincompletefissures[J].IEEETransonMedicalImaging,2010,29(6):12861296.
[54]DiciottiS,LombardoS,FalchiniM,etal.AutomatedsegmentationrefinementofsmalllungnodulesinCTscansbylocalshapeanalysis[J].IEEE TransonBiomedicalEngineering,2011,58(12):34183428.
[55]DiciottiS,PicozziG,FalchiniM,etal.3DsegmentationalgorithmofsmalllungnodulesinspiralCTimages[J].IEEETransonInformationTechnologyinBiomedicine,2008,12(1):719.
[56]KostisW J,ReevesAP,YankelevitzDF,etal.ThreedimensionalsegmentationandgrowthrateestimationofsmallpulmonarynodulesinhelicalCTimages[J].IEEETransonMedicalImaging,2003,22(10):125974.
[57]KuhnigkJM,DickenV,BornemannL,etal.MorphologicalsegmentationandpartialvolumeanalysisforvolumetryofsolidpulmonarylesionsinthoracicCTscans[J].IEEETransonMedicalImaging,2006,25(4):417434.
[58]OkadaK,ComaniciuD,KrishnanA.RobustanisotropicGaussianfittingforvolumetricchaacterizationofpulmonarynodulesinmultisliceCT[J].IEEETransonMedicalImaging,2005,24(3):409423.
[59]BoykovY,JollyM.Interactiveorgansegmentationusinggraphcuts[C]//Procofthe3rdInternationalConferenceonMedicalImageComputingandComputerAssistedIntervention.2000:276286.
[60]BoykovY,KolmogorovV.Anexperimentalcomparisonofmincut/maxflowalgorithmsforenergyminimizationinvision[J].IEEETransonPatternAnalysis&MachineIntelligence,2004,26(9):11241137.
[61]FordL,FulkersonD.Flowsinnetworks[M].NewJersey:PrincetonUniversityPress,1962.
[62]GoldbergA V,TarjanR E.A newapproachtothemaximumflowproblem[J].JournaloftheAssociationforComputingMachinery,1988,35(4):921940.
[63]BoykovY,VekslerO,ZabihR.Fastapproximateenergyminimizationviagraph cuts[J].IEETrans on Pattern Analysis &MechineIntelligence,2001,23(11):12221239.
[64]YeX,SiddiqueM,DouiriA,etal.Graphcutbasedautomaticsegmentationoflungnodulesusingshape,intensityandspatialfeatures[C]//Procofthe2ndInternationalWorkshoponPulmonaryImageAnalysis.2009:103113.
[65]YeX,BeddoeG,SlabaughG.AutomaticgraphcutsegmentationoflesionsinCTusingmeanshiftsuperpixels[J].InternationalJournalofBiomedicalImaging,2010,2010:112.
[66]HintonGE.Reducingthedimensionalityofdatawithneuralnetworks[J].Science,2006,313(5786):504507.
[67]HintonGE,OsinderoS,TehYW.Afastlearningalgorithm fordeepbeliefnets[J].NeuralComputation,2006,18(7):15271554.
[68]EgmontPetersenM,RidderDD,HandelsH.Imageprocessingwithneuralnetworks:areview[J].PatternRecognition,2002,35(1):22792301.
[69]MisraJ,SahaI.Artificialneuralnetworksinhardware:asurveyoftwodecadesofprogress[J].Neurocomputing,2010,74(13):239
255.
[70]LiQing,CaiWeidong,WangXiaogang,etal.Medicalimageclassificationwithconvolutionalneuralnetwork[C]//Procofthe13thInternationalConferenceonControlAutomationRoboticsandVision.2015:844848.
[71]李梭.肺部CT影像慢阻肺病灶三维定量化分析研究[D].上海:中国科学院研究生院(上海技术物理研究所),2014.
[72]LoP,VanGinnekenB,ReinhardtJM,etal.ExtractionofairwaysfromCT(EXACT’09)[J].IEEE TransonMedicalImaging,2012,31(11):20932107.
[73]LOLA11[EB/OL].http://www.lola11.com/.
[74]VESSEL12[EB/OL].http://vessel12.grandchallenge.org/.



